Research Progress
-
复旦大学丁玉强教授/宋宁宁副研究员揭示转录因子Nr4a2在海马下托神经元命运决定和小鼠社交障碍中的关键作用
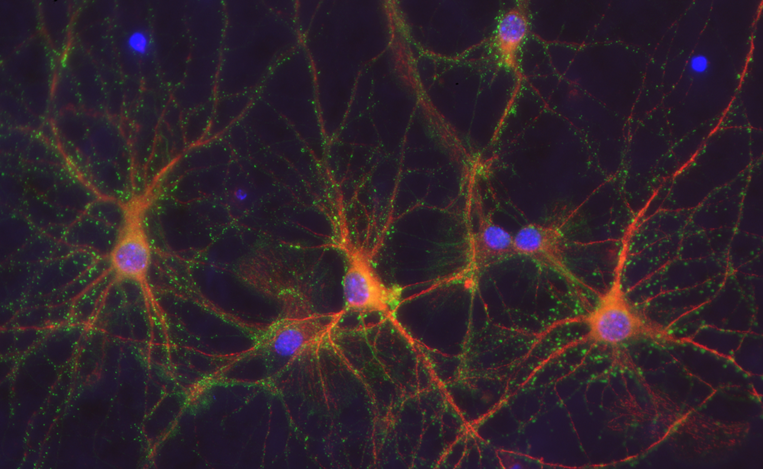
海马下托作为海马的主要输出节点,在学习记忆和空间导航等高级脑功能中具有重要地位。然而,关于下托神经元在发育过程中如何获得特定的分子身份,以及其在社交行为中的功能尚不清楚。近期,复旦大学丁玉强教授/宋宁宁副研究员团队在 Journal of Advanced Research 在线发表题为 “Essential function of Nr4a2 in subicular development and social novelty” 的研究工作,全面阐明了转录因子Nr4a2在下托神经元分子特征形成及其功能维持中的关键调控作用。研究发现,转录因子Nr4a2在下托中高表达,并在下托神经元分子命运决定中发挥关键作用。胚胎发育期敲除Nr4a2可导致下托神经元特异性基因表达缺失或显著下调,提示其分化过程受损。此外,下托与压后皮质之间存在致密的投射连接,Nr4a2缺失同时导致该通路受损。行为学观察显示,小鼠表现出明显的社交新颖性识别障碍。进一步在成年时期特异性敲除该基因,同样会引发下托神经元标记基因下调、前述神经环路功能受损以及社交行为异常。机制研究表明,Nr4a2可直接结合并激活下托神经元特异性
-
丁玉强课题组合作揭示G6PD在引发精神分裂症样行为及调控突触功能中的关键作用
葡萄糖-6-磷酸脱氢酶(G6PD)是磷酸戊糖途径(PPP)中的关键限速酶,通过调控还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的生成,在维持细胞生物合成及氧化还原稳态中发挥核心作用,其在神经保护中的功能已得到广泛认可。近年来的临床研究提示,G6PD缺乏可能与精神分裂症存在关联,但二者之间的因果关系及其潜在生物学机制仍不明确。2025年10月31日,复旦大学实验动物中心丁玉强团队与同济大学医学院张磊团队在《Translational Psychiatry》期刊发表题为“G6PD deficiency in brain induces schizophrenia-like behaviors and synaptic dysfunction”的研究论文。该研究首次在动物模型中证实,脑内特异性G6PD缺乏可直接引发精神分裂症样行为,并揭示其通过破坏突触结构与功能稳态参与疾病发生的关键机制。研究人员构建了大脑皮质和海马区特异性G6PD基因敲除(CKO)小鼠模型,有效模拟了G6PD缺乏的病理状态,表现为小鼠脑组织中G6PD蛋白表达及酶活性显著下降,并伴随氧化还原平衡紊乱。行为学评估显示,CKO小
-
丁玉强课题组揭示SATB1在神经发育障碍疾病中的作用
神经发育障碍(Neurodevelopmental disorders,NDDs)是一类由脑发育异常引起的常见疾病,涵盖智力障碍、自闭症谱系障碍及注意力缺陷与多动障碍等。尽管NDDs病因尚未完全明确,但遗传因素已被证实在其中发挥重要作用。2025年6月26日,复旦大学实验动物中心丁玉强教授课题组在Acta Pharmacologica Sinica上发表“A rat Satb1truncation causes neurodevelopmental abnormalities recapitulating the symptoms of patients with SATB1 mutations”,揭示了SATB1在大鼠脑发育中的作用及其参与NDDs发生的调控机制。转录因子SATB1(Special AT-rich sequence binding protein 1)在核基质附着区结合下游基因并参转录调控,从而在多种生物学过程中发挥重要作用。临床数据显示,携带SATB1致病性突变的患者普遍出现神经发育迟缓、智力障碍、脑发育异常等NDDs的典型症状,但有关SATB1如何参与NDDs的发
Contact
Address: Building No.25,
130 Dong An Road, Fudan University
Postal Code: 200032
Tel.: (86) 021-54237169